Lesen Sie hier, was uns gerade bewegt. Sehen Sie sich gerne auch weiterführende aktuelle Informationen in unserem WIKI-MEDIACC-Bereich an.

Wearables mit Evidenz in die Leitlinien
Smartwatch-basiertes PPG- und EKG-Screening detektiert Vorhofflimmern bei Hochrisikopatienten laut EQUAL-Studie viermal häufiger als Standardversorgung (HR 4,40). DGK-Leitlinien und HTA-Prozesse erhalten damit eine belastbare klinische Evidenzbasis.

Der unregulierte Therapeut
KI-Chatbots wie ChatGPT fungieren für Millionen als de-facto-Anbieter psychologischer Unterstützung – ohne HIPAA, ohne FDA-Kontrolle, mit minimalen Sicherheitsnachweisen. Tragische Todesfälle und das inhärent unterwürfige Verhalten machen evidenzbasierte Überwachung unabdingbar.

Vision trifft auf Bürokratie: Kann die EU Gesundheitsinnovationen wirklich neu erfinden?
Das Ende 2025 angekündigte EU-Gesundheitspaket vereint Biotech-Gesetz, reformierte Medizinprodukteverordnungen und Safe Hearts Plan. Fragmentierung, Finanzierungslücken und schwache Translationsrahmen lassen jedoch Zweifel an der tatsächlichen Transformationskraft aufkommen.

Anpassung des MDR? Vorschläge für Änderungen in Art. 74
Der Änderungsvorschlag zu Art. 74 der MDR verlangt, dass PMCF-Untersuchungen künftig konsequent im PMCF-Plan verankert werden. Die Dokumentationspflichten werden auf Kapitel II, Abschnitte 1, 3 und 4 des Anhangs XV eingegrenzt, doch Rechtsunsicherheiten zum Nachweisumfang bleiben bestehen.

Der neue Vorschlag der EU-Kommission für die MDR
Der EU-Kommissionsvorschlag zur Änderung der MDR und IVDR stärkt nichtklinische Nachweise bei der Konformitätsbewertung und erleichtert die Nutzung von Gleichwertigkeit. PMCF-Ergebnisse können künftig direkt in die klinische Bewertung integriert werden, separate Berichte entfallen.

What is new for clinical investigations of medical devices in Europe - dissecting the MDR evaluation
Die MDR-Evaluation 2025 belegt stabile klinische Prüfungen (~85 % Genehmigungsrate), zunehmende PMCF-Studien und den Bedarf einer zentralen EU-Koordination. Post-Market-Surveillance und Vigilanz wurden verbessert, doch Ressourcenlücken und uneinheitliche Umsetzung hemmen die volle MDR-Wirkung.

Gestaltung globaler Standards in der klinischen Forschung
Caroline Schmidt-Lucke wurde in die Komitees ISO/TC 194 und NA 027-07-20 AA für ISO 14155 berufen. Die Norm ISO 14155:25 setzt den globalen Maßstab für klinische Untersuchungen von Medizinprodukten und digitalen Gesundheitsanwendungen.

Über Pilotprojekte hinaus: Wie nordische Systeme digitale Gesundheit zur Routine machen
Estlands elektronische Patientenakte und Finnlands eMOM-App für Schwangerschaftsdiabetes zeigen, wie digitale Gesundheitsanwendungen über Pilotprojekte hinaus klinisch wirksam skalieren. Robuste Governance, Interoperabilität und evidenzbasierte Tools erweisen sich als zentrale Erfolgsfaktoren.

Von der Theorie zur Routine: KI-gestützte dezentrale klinische Studien
KI-gestützte dezentrale klinische Studien verbinden Fernüberwachung und digitale Endpunkte mit den Anforderungen aus MDR und ISO 14155:2020. Das EU-KI-Gesetz klassifiziert KI-Systeme nach Risiko und schreibt Konformitätsbewertung sowie menschliche Aufsicht vor.
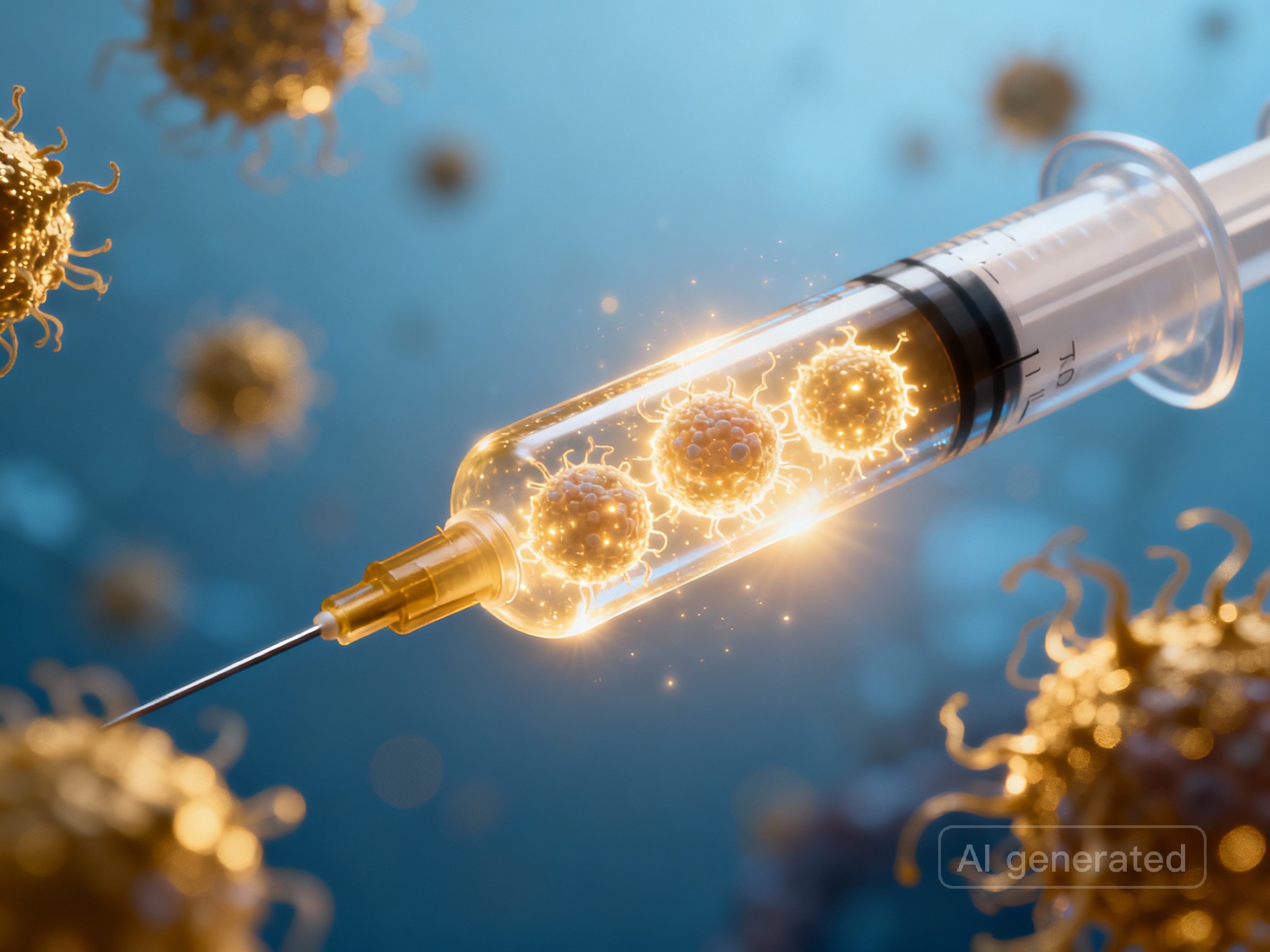
Krebsimpfung – ein Meilenstein der modernen Medizin?
mRNA-basierte Immuntherapien mobilisieren das Immunsystem gezielt gegen bereits existierende Tumore und gehen damit weit über klassische Impfungen hinaus. Erste klinische Studien belegen signifikant verbesserte Überlebensraten durch personalisierte, antigenbasierte Ansätze.
Zeigen Sie den medizinischen Nutzen Ihres Produkts
Mit unserer langjährigen Erfahrung und Expertise bieten wir effektive Lösungen, um den medizinischen Nutzen Ihres Produktes zu zeigen.
Von der Konzeption bis zur Durchführung von präklinischen und klinischen Studien unterstützen wir Sie mit maßgeschneiderten Dienstleistungen.
Erfahren Sie, wie MEDIACC Ihnen zur Erstattungsfähigkeit Ihrer Produkte helfen kann.
